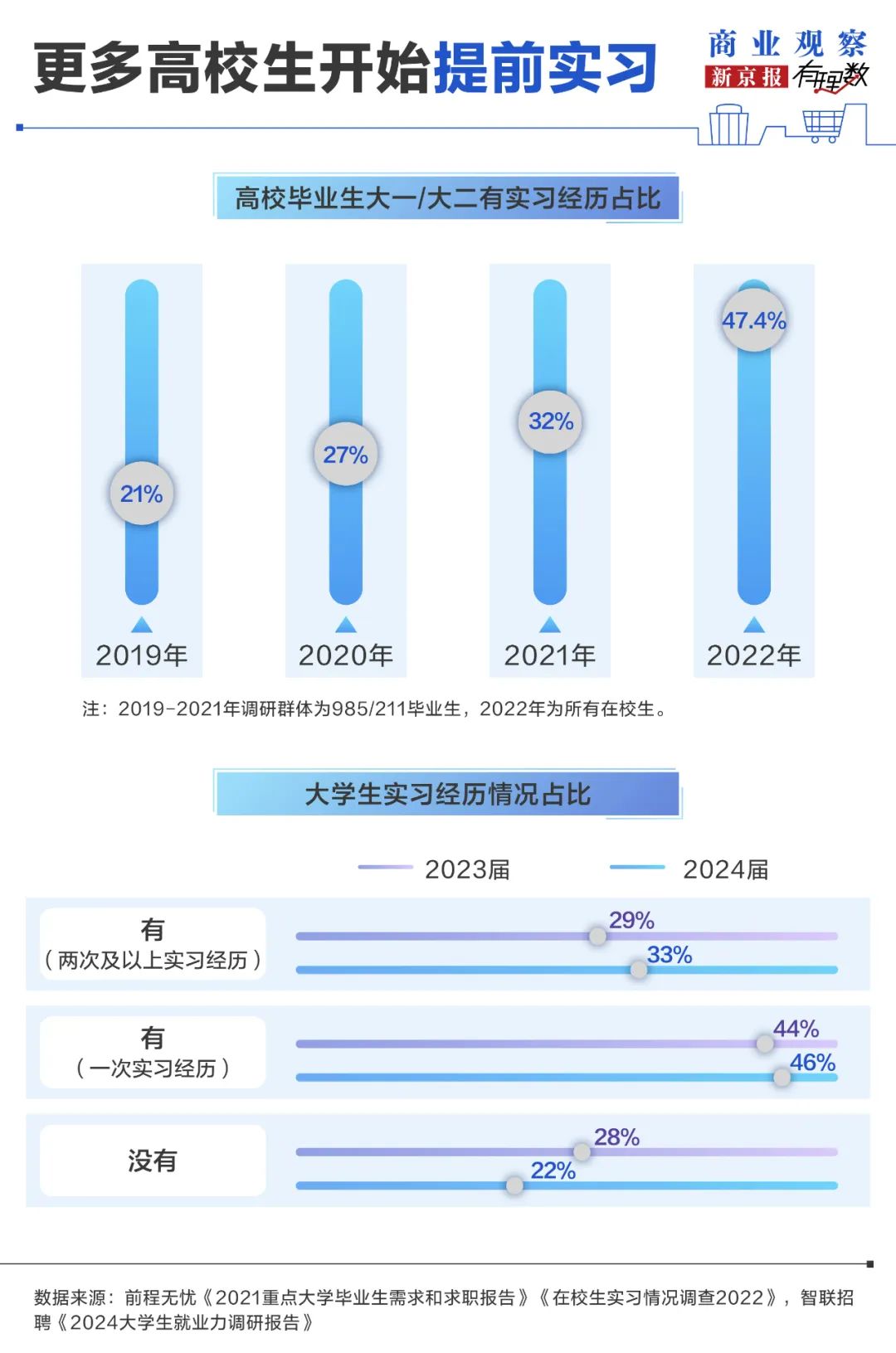
铁死亡:解锁人类疾病治疗新靶点的“细胞自杀密码”
2022年,《自然》子刊发表的一项研究揭示了帕金森病患者脑内铁蓄积与神经元死亡的关系,这一发现将“铁死亡”(Ferroptosis)这一术语推向了医学研究的前沿。
引言:细胞死亡新机制引发医学革命
2022年,《自然》子刊发表的一项研究揭示了帕金森病患者脑内铁蓄积与神经元死亡的关系,这一发现将“铁死亡”(Ferroptosis)这一术语推向了医学研究的前沿。不同于传统认知的细胞凋亡或坏死,铁死亡是一种铁依赖性、脂质过氧化驱动的程序性细胞死亡方式。自2012年由Brent Stockwell团队首次命名以来,铁死亡迅速成为癌症、神经退行性疾病、心血管疾病等领域的研究焦点。科学家们发现,操纵这一过程可能为治疗多种难治性疾病提供全新策略。
铁死亡的“分子开关”:从脂质过氧化到铁代谢失衡
铁死亡的核心机制围绕两个关键因素:铁离子超载和脂质过氧化连锁反应。正常细胞通过GPX4(谷胱甘肽过氧化物酶4)等抗氧化系统清除脂质过氧化物,维持膜结构稳定。然而,当GPX4失活(如参考文献4中通过基因敲除诱导的小鼠急性肾衰竭模型),或ACSL4(酰基辅酶A合成酶长链家族成员4)异常激活时,细胞膜中的多不饱和脂肪酸(PUFA)发生不可逆过氧化,最终导致细胞膜崩解。
近期研究进一步揭示,**铁代谢调控蛋白如SLC7A11(胱氨酸/谷氨酸逆向转运体)和铁转运蛋白(Ferroportin)**在铁死亡中扮演“交通警察”角色。例如,肿瘤细胞通过高表达SLC7A11大量摄入胱氨酸合成谷胱甘肽,抵抗铁死亡;而阿尔茨海默病患者脑内Ferroportin表达下降,导致神经元铁蓄积并加速退化。
疾病战场:铁死亡的双刃剑效应
癌症治疗:精准诱导铁死亡破解耐药难题
铁死亡在肿瘤领域展现出巨大潜力。例如,三阴性乳腺癌中常见的KRAS突变会激活SLC7A11,增强癌细胞对铁死亡的抵抗。而通过纳米颗粒或药物erastin抑制SLC7A11,可选择性诱导肿瘤细胞铁死亡。更令人振奋的是,铁死亡还能逆转免疫治疗耐药:CD8+ T细胞通过分泌IFN-γ抑制肿瘤细胞SLC7A11表达,使其更易被铁死亡清除。目前,针对GPX4抑制剂RSL3和铁螯合剂Deferoxamine的临床试验已在晚期实体瘤中展开。
神经退行性疾病:阻断铁死亡守护大脑健康
阿尔茨海默病(AD)和帕金森病(PD)患者脑内普遍存在铁异常沉积。研究发现,AD模型小鼠中,铁转运蛋白Ferroportin表达下调导致神经元铁超载,而补充维生素D受体激动剂可通过激活Nrf2/GPX4通路抑制铁死亡。在PD中,α-突触核蛋白聚集通过引发线粒体铁释放和脂质过氧化加速多巴胺能神经元死亡。针对这一机制,铁螯合剂去铁胺已在PD动物模型中显示出保护作用。
心血管疾病:心肌细胞存亡的关键平衡
心肌缺血再灌注损伤中,铁死亡是导致细胞死亡的主要途径。研究发现,再灌注阶段线粒体释放大量游离铁,通过ACSL4依赖的脂质过氧化引发心肌细胞死亡。而靶向ACSL4的小分子化合物(如Baicalin,)或激活Nrf2/GPX4通路的中药成分(如丹参酮IIA)可显著减轻心肌损伤。此外,铁死亡还与心力衰竭进展相关,心衰患者心肌组织中GPX4水平显著降低,而补充辅酶Q10类似物可恢复其活性。
挑战与突破:铁死亡调控药物的研发竞赛
尽管前景广阔,铁死亡研究仍面临转化难题。首先,铁死亡具有组织特异性:肝脏中抑制铁死亡可缓解脂肪肝,但在癌症中需选择性诱导。其次,现有工具药如Ferrostatin-1虽在动物模型中有效,但存在代谢稳定性差的问题。近年来,科学家通过高通量筛选发现了新型铁死亡抑制剂Liproxstatin-1和维生素K类似物,其长效性和安全性更优。
更值得关注的是,铁死亡与其他细胞死亡方式的交互作用可能影响疗效。例如,p53既能通过抑制SLC7A11促进铁死亡,又能通过调控自噬抑制该过程。因此,开发时空特异性调控策略成为关键。基因编辑技术(如CRISPR筛选,参考文献59)和单细胞测序正在帮助科学家绘制更精确的“铁死亡调控图谱”。
未来展望:从实验室到临床的最后一公里
铁死亡研究正在改写疾病治疗范式。在诊断方面,血浆中氧化脂质标志物(如MDA和4-HNE)可作为铁死亡相关疾病的生物标志物。在治疗领域,结合铁死亡诱导剂与免疫检查点抑制剂的联合疗法已在临床前模型中显著抑制肿瘤生长。此外,针对神经退行性疾病的铁螯合剂改良版(如PBT2)已进入II期临床试验。
正如论文通讯作者王福俤教授所言:“铁死亡为理解疾病本质提供了全新视角,其转化应用将开启精准医学的新篇章。”随着分子机制的不断阐明和新型药物的开发,这场围绕“细胞铁死亡”的医学革命,正在为无数患者带来曙光。
来源: 医学前沿FrontMed