Nature重磅:孕期缺这种元素,或致胎儿性别逆转!
传统生物学认为,哺乳动物的性别由染色体决定——XY为雄性,XX为雌性。然而,日本大阪大学在《自然》发表的最新研究却颠覆了这一认知。研究发现,当母体铁元素缺乏时,携带Y染色体的雄性小鼠胚胎可能完全发育为具有生育能力的雌性个体。
传统生物学认为,哺乳动物的性别由染色体决定——XY为雄性,XX为雌性。然而,日本大阪大学在《自然》发表的最新研究却颠覆了这一认知。研究发现,当母体铁元素缺乏时,携带Y染色体的雄性小鼠胚胎可能完全发育为具有生育能力的雌性个体。

在哺乳动物胚胎发育过程中,性别决定是一个精密调控的过程。对于雄性胚胎而言,Y染色体上的Sry基因是启动雄性发育的关键。然而,Sry基因的激活并非自发完成,而是依赖于一系列复杂的表观遗传调控,其中铁元素扮演着重要角色。
铁元素作为一种关键辅助因子,参与了组蛋白去甲基化酶的活性调控。以KDM3A为例,这种酶能够去除组蛋白H3赖氨酸9位点的甲基化修饰(H3K9me2),而这一修饰通常会抑制基因的表达。在雄性胚胎的性别决定关键期(约48小时),前支持细胞(pre-Sertoli cells)会大量囤积铁元素,其铁摄取速率几乎是邻近细胞的2倍。这些铁元素正是KDM3A等酶发挥作用所必需的“燃料”,它们通过催化组蛋白去甲基化反应,解除Sry基因的转录抑制,从而开启雄性发育的路径。

缺铁消除了培养性腺中的Sry激活
研究人员通过一系列实验验证了这一机制。当在体外培养的雄性胚胎性腺中加入铁螯合剂(如去铁胺DFO),KDM3A介导的H3K9去甲基化过程受到显著抑制,Sry基因的表达水平急剧下降,同时性腺开始表达卵巢特异性标记(如FOXL2),表明其向雌性发育方向转变。在体内实验中,敲除铁转运基因Tfrc导致胚胎细胞缺铁,部分雄性小鼠胚胎发育为雌性,具备完整的卵巢和雌性生殖器官,进一步证实了铁元素在性别决定中的关键作用。
母体的营养状况直接影响胚胎的发育环境,而铁元素的供需平衡在其中尤为关键。研究发现,当孕鼠摄入缺铁饮食或接受铁吸收抑制剂(如地拉罗司DFX)治疗时,其体内铁水平显著下降,进而导致子代雄性胚胎出现性别逆转。
具体而言,缺铁孕鼠的雄性后代中,约7%发生了雄性到雌性的性别反转,72只 XY 后代中,4只发育出双侧卵巢,1只发育了一个卵巢和一个睾丸。在同时携带Kdm3a杂合突变的胚胎中,约5%的XY后代发生雄性到雌性的性别反转,43只XY后代中,2只发育出双侧卵巢。
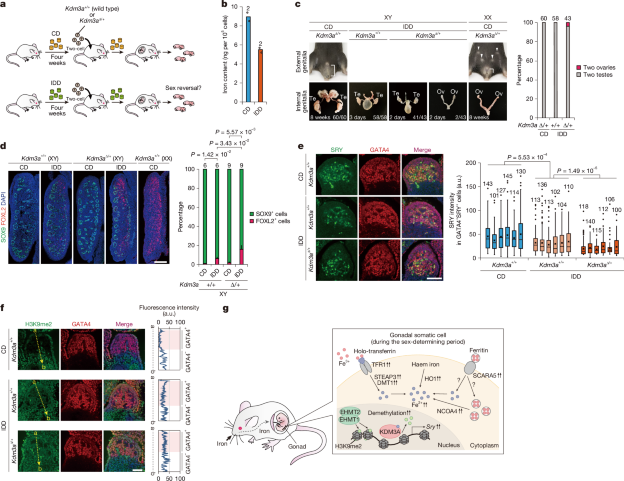
饮食诱导的母体缺铁损害了子宫内胚胎发育过程中的雄性性别决定途径
进一步研究表明,胚胎细胞在缺铁时会启动应急机制,上调铁转运蛋白(如Tfrc)和铁依赖酶的表达,试图弥补铁的不足。然而,这种“自救”往往徒劳无功,因为性别决定的关键窗口期一旦错过,发育路径的改变便不可逆转。值得警惕的是,细胞内铁代谢的反馈机制可能掩盖缺铁的真实状态——尽管细胞通过增加铁相关蛋白的表达维持表面的“平衡”,但深层次的表观遗传损伤已悄然发生。
全球范围内,约35.5%的孕妇存在缺铁问题,而缺铁性贫血更是孕期常见的并发症。这项研究提示,生命的早期发育远比想象中脆弱,母体缺铁可能不仅仅影响胎儿的血液系统发育,还可能对性别决定等基础发育过程产生深远影响。
当前的孕妇补铁指南主要基于预防贫血的考量,但该研究表明,即使是轻度缺铁(铁水平降至正常的40%),在遗传易感性的背景下,也可能引发性别发育异常。因此,未来的临床实践可能需要更精准地评估孕妇的铁代谢状态,尤其是对携带铁代谢相关基因突变的高危人群,需制定个性化的补铁方案。此外,研究中发现的铁依赖表观遗传机制,也为探索其他微量元素(如锌、铜等)在胚胎发育中的作用提供了新方向。
数据图及参考来源:
https://www.nature.com/articles/s41586-025-09063-2