扑朔迷离的原子核
2018科普创客大赛复赛成人组晋级作品。
〖2018年“科普创客大赛”参赛作品,版权归大赛主办方所有,任何媒体、网站或个人不得转载!违者追究相应法律责任!〗
如果要问物质是由什么构成的,大家可能很快答出,物质是由原子构成的,原子是由原子核和核外电子构成的,原子核是由质子、中子等更小的粒子构成的。
形形色色的物质宇宙,只不过由有限的几种基本粒子构成。到目前为止,人类已经确认的化学元素有119种,自然存在的有94种,即1号元素氢~94号元素钚,后面的元素都是人工制取的。这些元素都是由电子、质子、中子等几种基本粒子构成。而中子其实是由质子、电子、中微子组成的复合粒子。
1869年,俄国化学家门捷列夫发现元素周期律。现在的教科书上使用的化学元素周期表,就是根据门捷列夫元素周期律完善而来。那么,元素的性质随着元素原子序数的递增呈周期性递变的神奇规律的背后,是不是隐藏着某种玄机?
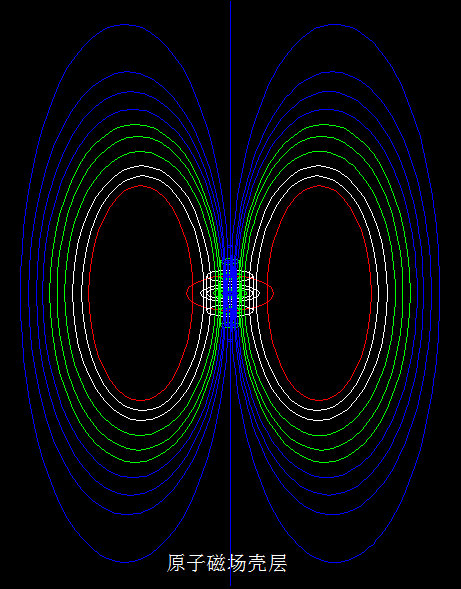
在原子体系里,原子核极小,它的直径在10-15m~10-14m之间,体积只占原子体积的几千亿分之一,在这极小的原子核里却集中了99.96%以上原子的质量。
为什么在原子体系里,拥有绝大部分原子质量的原子核所占据的空间却极小?原子核外空间极其宽阔,而电子为什么却分布在有限的几个壳层里?是什么限制了电子的行为方式?
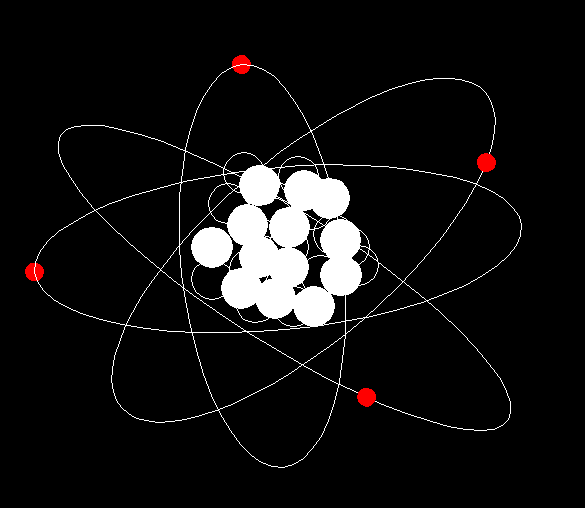
关于原子结构模型,我们通常看到这样的图画:
真实的原子结构会是这样的吗?
1911年,英国科学家卢瑟福通过实验证明原子中心有一个极小的核,电子绕核做高速旋转。
后来,通过大量的原子光谱的实验和研究,科学家们意识到核外电子不是杂乱无章的随机运动,也不是充斥核外整个空间的均匀运动,而是分布在有限的几个壳层里运动,并且有规律可循。这就是核外电子排布的三大规律,能量最低原理、泡利不相容原理、洪特规则。
能量最低原理,就是一个体系,能量越低,体系越稳定。比如原子,如果想要稳定存在,那么它必须待在基态,而不是激发态。核外电子总是优先占据能量更低的轨道,使整个原子处于能量最低的状态。
泡利不相容原理,在原子里,不能存在两个或两个以上的运动状态完全相同的电子。换句话说,就是同一个原子轨道上最多只能容纳两个电子,且这两个电子的自旋状态必须相反。
洪特规则,进一步说明,在具有多个能量相同的原子轨道时,电子总是尽可能分占不同的轨道,且自旋状态相同。
核外电子这种奇怪的行为,让人难以理解。核外空间那么大,电子完全可以一个电子一个轨道地运行,没有必要结伴而行,更没必要好几个轨道处在同一个电子层里。是什么力量迫使电子在原子核外作这种奇特的运动呢?
要想弄明白核外电子的排布,仅靠这几个由实验总结出来的排布规律是不行的。核外电子的排布,看来应该与原子核有关。因为,如果不考虑原子核的影响,核外电子杂乱无章的运动,更能使原子体系的能量最低。电子带有电荷,绕核高速旋转,必定产生磁矩。电子杂乱无章地运动,更容易抵消磁矩,使整个原子体系对外不显磁矩,原子更能稳定存在,也就是常说的化学惰性。而实际上,绝大部分原子存在磁矩,化学性质活泼,容易组成分子或原子集团。这就说明,核外电子的运动,与原子核有关。
大家可能认为原子核是由质子和中子密集在一起组成的实核。但根据核外电子的排布,很可能不是这样的,也就是说,原子核也具有精细结构。正是这种精细结构,才导致了核外电子的这种奇特排布。
那么原子核的精细结构又是什么样子的呢?
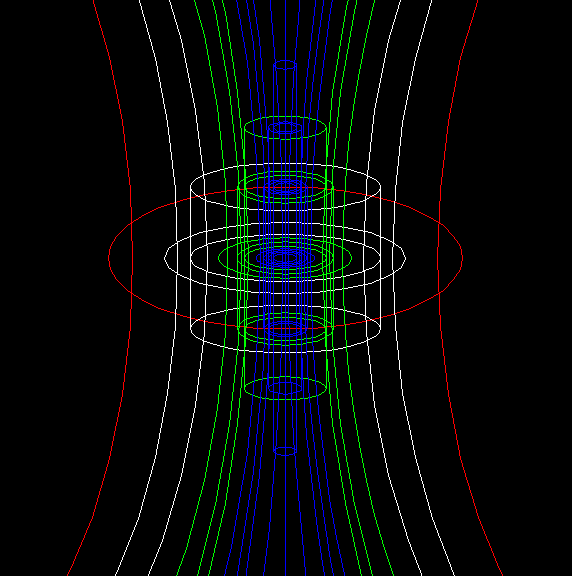
我认为,核子不是密集在一起,而是在做涡旋运动,形成若干个核子环,核子环沿轴向排布,呈套筒形状。核子环不是静态的,是环状涡旋。
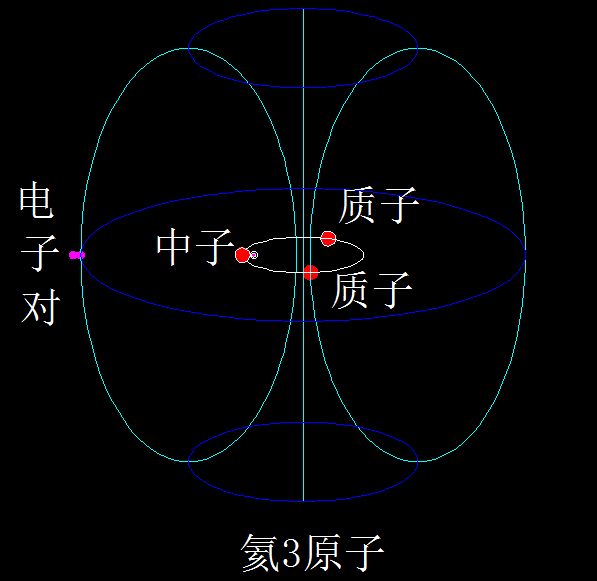
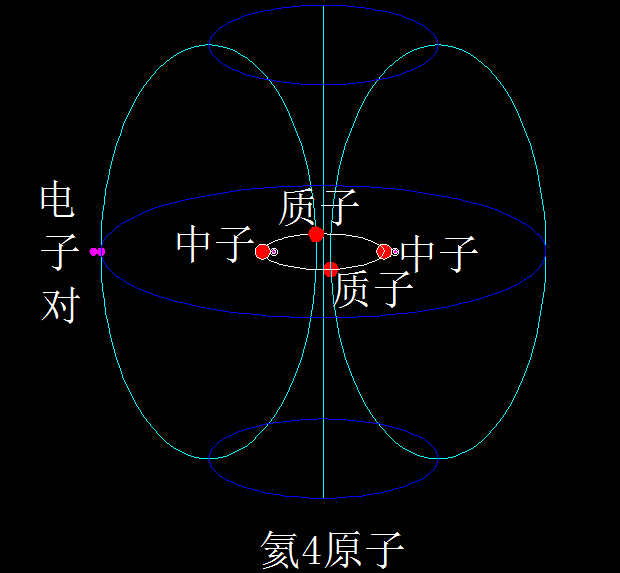
下面是最简单的5种元素原子的结构示意图:氕、氘、氚、氦3、氦4,
这些是氕、氘、氚、氦3、氦4的原子结构模型,核外电子在核子环涡旋产生的磁场壳层里、围绕公转轴的两极之间做来回的螺旋运动。
这里需要指出,氕核里的质子与单独存在的质子,在物理性质上是不同的,氕核里的质子在做涡旋运动,形成核子环,产生核磁矩,具有核能,但核能的释放不会导致质子的消失。单独存在的质子在做无规则的热运动,当然质子本身自旋,也有磁矩,也有能量,但不是核能,质子与反质子发生湮灭,释放能量,这个能量比核能大得多。不过湮灭之后,质子就消失了。
还有,核子环里的中子与单独存在的中子,在物理性质上也是不同的。中子是质子俘获一个电子而形成的复合粒子,但如果直接俘获,电子必然会与质子发生湮灭,导致质子和电子都消失。为了避免这种事情发生,电子必须先俘获中微子,穿上中微子的外衣,形成复合粒子“电子中微子”,电子有了中微子这个隔离外套,就可以贴近质子表面运动而不被湮灭。中子就是质子、电子、中微子构成的复合粒子。当然,中子也有反中子,由反质子、反电子、中微子构成。单独存在的中子没有核能。
中子可以单独形成核子环,这就是所谓的0号元素。实际上,核外电子在某种特殊条件下,被核内质子俘获,就形成了0号元素,也就是原子的坍缩,形成高密度的物质。核子环里的中子具有核能。
一个稳定存在的核子环里,最多只能有4个核子(即质子和中子)。但没有4个核子都是质子的核子环(例如不存在铍4),也没有3个核子都是质子的核子环(例如不存在锂3),也没有2个核子都是质子的核子环(例如不存在氦2)。这就说明,核子环的构成有讲究。
之所以不存在纯质子的核子环,是因为质子与质子之间存在库伦斥力,距离越近,斥力越大。而中子的存在就可以减弱这种斥力。那么中子是怎么减弱库伦斥力的呢?原来,中子里具有电子中微子。
在核子环里,中子里的电子中微子是游离的,或者说核子环里的中子呈半中子半质子状态,核子环里的质子呈半质子半中子的状态(氕核子环只有一个质子,不存在库伦斥力,例外)。电子中微子穿梭在核子之间,像胶水一样将核子粘结在一起,形成稳定的核子环。像电子中微子这类具有胶合核子的复合粒子,也被叫作胶子。
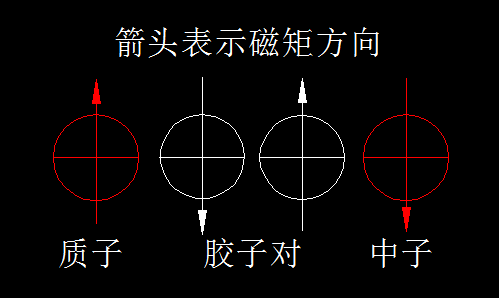
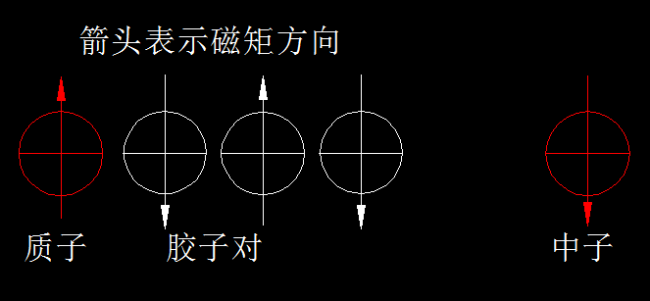
仅靠胶子的游离运动就能让核子环稳定存在还是不够的。粒子世界的神奇之处就是追求极致。我们知道,核子除了涡旋运动,自身还在自旋,如果自旋状态相同,产生的磁矩必然相互排斥,这就减弱了核子环的稳定性。所以,核子环里的核子自旋尽可能彼此相反,且自旋方向与核子环的磁矩方向相同或相反,其它方向则被限制,这是磁场强迫的结果。我们可以把核子想象为小磁体,小磁体极性相同,很难靠近,但彼此极性相反,则紧紧吸在一起。
除了核子自旋状态彼此相反而增加稳定性外,还有一个因素不容忽视,那就是胶子的自旋。胶子(电子中微子)的性质与电子相似,自旋也会产生磁矩。如果自旋状态相同,势必相互排斥,不能在核子环内稳定运行。所以,2个质子与2个中子构成的核子环最稳定,因为自旋相反、结伴而行的2个胶子(胶子对或电子对)比一个胶子具有更强的胶合力。
那么,核子环内可不可以有3个胶子呢?甚至更多呢?按照推理,胶子更多,胶合力更大呀?其实不然。下图是核子环里的胶子对的存在状态:磁矩方向彼此相反,具有胶合作用。
如果存在3个胶子,则无法达到磁矩彼此相反的稳定状态,起不到胶合作用。这就是泡利不相容原理的原因。
所以,0号元素不能稳定存在3个或4个中子的同位素,只有1个或2个中子的0号元素。核子环里最多只有2个胶子的特性,决定了核外电子在每个轨道里的排布最多只有2个,且自旋相反。这是磁场强迫的结果。
上面分析的都是单一核子环的原子,得出的结论是,一个核子环最多只有4个核子。一个核子环最多只有2个胶子。不能有2个或2个以上纯质子的核子环,不能有3个或3个以上纯中子的核子环。这些质子、中子、胶子的磁矩在磁场的强迫下,取向相同或相反,并尽可能彼此相吸。2个质子和2个中子的核子环最稳定,相当于一个复合粒子,即α(阿尔法)粒子。
那么,超过3个质子的原子核,其内部精细结构又是怎样的呢?
根据元素周期表的事实,原子核的精细结构如下图所示:
核子排布与核外电子排布顺序恰恰相反。电子从内向外排布,核子从外向内排布。这是磁场壳层导致的,是磁场强迫的结果。
红色为第一层,只有1个核子环。如氢、氦。
白色为第二层,有2个亚层,第一亚层只有1个核子环,第二亚层有3个核子环,以赤道面,对称分布。如锂、铍、硼、碳、氮、氧、氟、氖。
绿色为第三层,有3个亚层,第一亚层只有1个核子环;第二亚层有3个核子环,以赤道面,对称分布;第三亚层有5个核子环,以赤道面,对称分布。如钠、镁、铝、硅、磷、硫、氯、氩。
蓝色为第四层,有4个亚层,第一亚层只有1个核子环;第二亚层有3个核子环,以赤道面,对称分布;第三亚层有5个核子环,以赤道面,对称分布;第四亚层有7个核子环,以赤道面,对称分布。如钾、钙……溴、氪。
还有第五层、第六层、第七层,这里就不一一例举了。
这是生命元素碳12原子的结构模型。
红色表示的是第一层核子环产生的磁场壳层,第一层核子环由2个质子、2个中子组成,磁场壳层里有2个电子。
白色表示的是第二层核子环产生的磁场壳层,第二层又分两个亚层,第一亚层核子环也是由2个质子、2个中子组成,磁场壳层里有2个电子;第二亚层可以有3个核子环,赤道上一个,赤道两边对称分布各一个,如果3个核子环全部充满,就是氖元素的原子核氖20。但碳12只有12个核子,除去第一层核子环4个、第二层第一亚层核子环4个核子,只剩下2个质子、2个中子,这4个核子优先排进对称的两个亚层上,即一个质子与一个中子进入上亚层,另外一个质子与一个中子进入下亚层,而空置赤道亚层。这样的结构是磁场强迫的结果。这样的原子核结构,核外电子最外层的电子云呈现在赤道区域形成两个对称的密集区。CO2 分子中的碳原子就是这种结构。
由于第二层赤道亚层空置,第一亚层的核子很容易填补进来,形成第一亚层核子环存在1个质子和1个中子;第二亚层三个亚层核子环都是1个质子和1个中子。这相当于sp2轨道杂化。这样的原子核结构,导致核外电子最外层的电子云呈现在赤道区域形成3个均匀分布的密集区(即平面正三角形)。石墨中的碳原子就是这种结构。
如果提供足够的能量,第二层第一亚层的核子环将激发到第二亚层,形成5亚层结构,其中赤道亚层空置,其它4个亚层都是1个质子和1个中子。这相当于sp3轨道杂化。这样的原子结构,导致核外电子最外层的电子云呈现在赤道两边的球面上形成2个均匀分布的密集区域(共4个),(即正四面体)。金刚石中的碳原子就是这种结构。
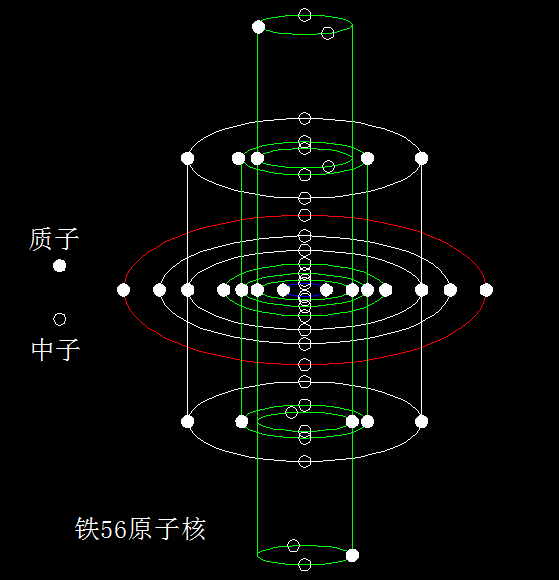
在所有原子核中,铁56原子核是最稳定的,在元素周期表中,比铁56轻的元素聚变释放能量,比铁56重的元素裂变释放能量,唯有铁56,聚变和裂变都要吸收能量,而且需要非常苛刻的条件。
下面我们来分析铁56的原子核精细结构,寻找铁56超级稳定性的原因。按照正常的分析,铁56的原子核结构如下图所示。不过,我们发现,原子核的最内层有一个2个质子和2个中子构成的核子环。次内层有五个轴向排布的核子环,赤道层是2个质子和2个中子构成的核子环,两边各有两个1个质子和2个中子构成的核子环。这样的核子环排布和构成是非常的不稳定,与铁56的超级稳定性相悖。
我们知道,2个质子和2个中子构成的核子环,非常稳定,即α(阿尔法)粒子环。1个质子和2个中子构成的核子环,极不稳定。而铁56原子核里竟然有4个这样的不稳定结构。
另外,由于磁场的强迫效应,具有强磁矩的α(阿尔法)粒子环应该处在磁场两极,且对称排布。可铁56原子核的最内层和次内层的2个α(阿尔法)粒子环,却处在赤道面上。这也是不稳定的结构。
所以,铁56的原子核的精细结构不会是上图所示的那样,其核子环的排布和构成发生了优化,相当于sd轨道杂化。
优化后的铁56原子核的最内层的核子环如上图所示,赤道层空置,两极各有两个α(阿尔法)粒子环,且对称排布。赤道两边是2个中子构成的核子环,也对称排布。这样的优化排布,正是磁场强迫的结果。
另外,两极的α(阿尔法)粒子环产生了强烈的磁镜效应。在核衰变反应中,α粒子、β粒子或中子,无论是逃逸,还是吸收,都是通过两极发生的,其它的部位则被禁止,这是磁场强迫的结果。原子核的聚变和裂变,也是优先选择通过两极发生,特别是自发的核反应。
铁56原子核的最内层核子环形成了强烈的磁瓶结构,核内粒子的进出被强烈禁止。这就是铁56原子核超级稳定的原因。
还有,通过比对铁、钴、镍的原子核精细结构,钴、镍的原子核也具有铁相似的结构,这很有可能就是铁、钴、镍是铁磁性元素的原因。
铁是26号元素;钴是27号元素,比铁多1个质子;镍是28号元素,比铁多2个质子。中子不显电性,但质子是带电的,磁瓶内的质子做涡旋运动,产生的磁矩消弱了磁镜作用,所以,钴、镍就没有铁稳定。
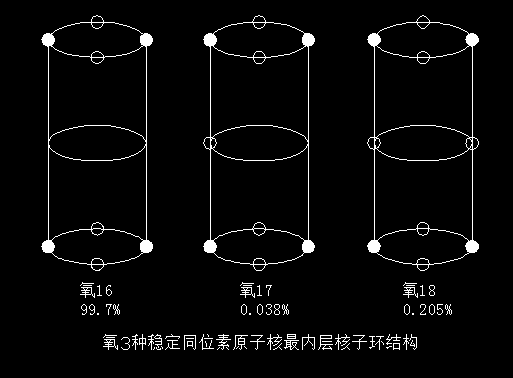
我们再来看看氧元素。如果按质量计算,氧在宇宙中的含量仅次于氢和氦,在地壳中,氧则是含量最丰富、分布最广泛的元素,占整个地壳质量的48.6%。分析氧原子核的精细结构,不难发现,氧原子核也具有铁56原子核的稳定结构。
下图是氧元素3个稳定同位素的原子核最内层核子环结构。
由于两极只有一个α(阿尔法)粒子环,磁镜效应自然没有铁56强烈。氧原子核的稳定性虽然比不过铁56,但也是一个出类拔萃的佼佼者。
研究原子核的精细结构,不仅有助于我们认识宇宙,了解天体演变,更有助于我们的科技发展。可控核聚变是我们梦寐以求的清洁能源。如果我们明白了氢、氦原子核的精细结构,电子、质子、中子、中微子的精细结构,冷核聚变可能不是传说。
虽然我们知道有很多物体具有超导性,但在常温下实用的超导体至今还没发现。核外电子的行为受制于原子核,如果明白了导电体的原子核的精细结构,应该不难揭示超导机制,研制出实用的超导体。
应用技术的高速发展,已让理论科学捉襟见肘。缺乏正确的理论指导,科技创新步履艰难。我们应该尽量避免像寻找白炽灯丝那样的低效劳动。科普不仅是传播现有的知识,更应是启迪思维,激发求知